Дж про уля - Т про мсона еф е кт, зміна температури газу в результаті повільного протікання його під дією постійного перепаду тиску крізь дросель - місцеве перешкода потоку газу (капіляр, вентиль або пористу перегородку, розташовану в трубі на шляху потоку). Перебіг газу крізь дросель ( дросселирование ) Має відбуватися без теплообміну газу з довкіллям (адіабатично).
Д. - Т. е. був виявлений і досліджений англійським ученими Дж. Джоулем і У. Томсоном в 1852-62. У дослідах Джоуля і Томсона вимірювалася температура в двох послідовних перетинах безперервного і стаціонарного потоку газу (до дроселя і за ним, рис. 1). Значне тертя газу у дроселі (мелкопористой пробці з вати) робило швидкість газового потоку нікчемно малою, так що при дроселюванні кінетична енергія потоку була дуже мала і практично не змінювалася. Завдяки низькій теплопровідності стінок труби і дроселя теплообмін між газом і зовнішнім середовищем був відсутній. При перепаді тиску на дроселі D p = p1 - р2, рівному 1 атмосфері (1,01 × 105 н / м2), виміряна різниця температур D T = T2 - T1 для повітря склала - 0,25 ° С (досвід проводився при кімнатній температурі ). Для вуглекислого газу і водню в тих же умовах D Т виявилася, відповідно, рівною - 1,25 і + 0,02 ° С.
Д. - Т. е. прийнято називати позитивним, якщо газ в процесі дроселювання охолоджується (D Т <0), і негативним, якщо газ нагрівається (D Т> 0).
Згідно молекулярно-кінетичної теорії будови речовини, Д. - Т. е. свідчить про наявність в газі сил міжмолекулярної взаємодії (виявлення цих сил було метою дослідів Джоуля і Томсона). Дійсно, при взаємному тяжінні молекул внутрішня енергія (U) газу включає як кінетичну енергію молекул, так і потенційну енергію їх взаємодії. Розширення газу в умовах енергетичної ізоляції не міняє його внутрішньої енергії, але призводить до зростання потенційної енергії взаємодії молекул (оскільки відстані між ними збільшуються) за рахунок кінетичної. В результаті тепловий рух молекул сповільниться, температура газу, що розширюється буде знижуватися. Насправді процеси, що призводять до Д. - Т. е., Складніше, тому що газ не ізольований енергетично від зовнішнього середовища. Він здійснює зовнішню роботу (подальші порції газу, праворуч від дроселя, тіснять попередні), а зліва від дроселя над самим газом здійснюють роботу сили зовнішнього тиску (підтримують стаціонарність потоку). Це враховується при складанні енергетичного балансу в дослідах Джоуля - Томсона. Робота продавлювання через дросель порції газу, що займає до дроселя об'єм V1, дорівнює p1V1. Ця ж порція газу, займаючи за дроселем об'єм V2, здійснює роботу p2V2. Виконана над газом результуюча зовнішня робота A = p1V1 - p2V2 може бути як позитивна, так і негативна. У адіабатичних умовах вона може піти тільки на зміну внутрішньої енергії газу: A = U2 - U1. Звідси, знаючи рівняння стану газу і вираження для U, можна знайти D T.
Величина і знак Д. - Т. е. визначаються співвідношенням між роботою газу і роботою сил зовнішнього тиску, а також властивостями самого газу, зокрема розміром його молекул.
Для ідеального газу, молекули якого розглядаються як матеріальні точки, що не взаємодіють між собою, Д. - Т. е. дорівнює нулю.
Залежно від умов дроселювання один і той же газ може як нагріватися, так і охолоджуватися. Температура, при якій (для даного тиску) різниця D T, проходячи через нульове значення, змінює свій знак, називається температурою інверсії Д. - Т. е. Типова крива залежності температури інверсії від тиску показана на рис. 2. Крива інверсії відокремлює сукупність станів газу, при переході між якими він охолоджується, від станів, між якими він нагрівається. Значення верхніх температур інверсії (Ti, max, рис. 2) для ряду газів приведені в таблиці.
Д. - Т. е., Що характеризується малими значеннями D T при малих перепадах тиску D р, називають диференціальним. При великих перепадах тиску на дроселі температура газу може змінюватися значно. Наприклад, при дроселюванні від 200 до 1 атмосфери і початковій температурі 17 ° С повітря охолоджується на 35 ° С. Цей інтегральний ефект покладений в основу більшості технічних процесів скраплення газів .
Літ .: Ландау Л. Д., Ахиезер А. І., Ліфшиц Е. М., Курс загальної фізики. Механіка і молекулярна фізика, М., 1965; Ландау Л. Д., Ліфшиц, Є. М., Статистична фізика, М., 1964 (Теоретична фізика, т. 5); Зоммерфельд А., Термодинаміка і статистична фізика, пер. з нім., М., 1955; Леонтович М. А., Введення в термодинаміку, 2 вид., М. - Л., 1952.
І. А. Яковлєв.
СО2
Ar
N2
H2
He
повітря
Ti, max, K
1500
723
621
202
50
603

Мал. 2. Крива інверсії азоту. В межах кривої ефект Джоуля - Томсона позитивний (D T <0), поза кривої - негативний (D Т> 0). Для точок на самій кривій ефект дорівнює нулю.
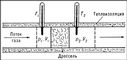
Мал. 1. Схема досвіду Джоуля - Томсона. У теплоизолированной трубці створюється стаціонарний протока газу. Після проходження газу через дросель його тиск p, уд. обсяг V і температура Т змінюються.