Класифікація спиртів різноманітна і залежить від того, яка буде ознака будови узятий за основу.
1. В залежності від кількості гідроксильних груп в молекулі спирти ділять на:
а) одноатомні (містять одну гідроксильну ОН-групу), наприклад, метанол СН3ОН, етанол С2Н5ОН, пропанол С3Н7ОН
б) багатоатомні (дві та більше гідроксильних груп), наприклад, етиленгліколь
HO -С H 2 CH 2 OH, гліцерин HO-СH2-СН (ОН) -CH2-OH, пентаеритрит С (СН2ОН) 4.
З'єднання, в яких у одного атома вуглецю

є дві гідроксильних групи, в більшості випадків нестабільні і легко перетворюються в альдегіди, отщепляя при цьому воду: RCH (OH) 2 ® RCH = O + H 2 O
Спирти, що містять три групи ОН у одного атома вуглецю

, не існує.
2. За типом атома вуглецю, з яким пов'язана група ОН, спирти ділять на:
а) первинні, у яких ОН-група пов'язана з первинним атомом вуглецю. Первинним називають атом вуглецю (виділено червоним кольором), пов'язаний всього з одним вуглецевим атомом. Приклади первинних спиртів - етанол С
H 3 CH 2 OH, пропанол З H 3 CH 2 CH 2 OH. б) вторинні, у яких ОН-група пов'язана з вторинним атомом вуглецю. Вторинний атом вуглецю (виділено синім кольором) пов'язаний одночасно з двома атомами вуглецю, наприклад, вторинний пропанол, вторинний бутанол (рис. 1). 
Мал. 1. БУДОВА ВТОРИННИХ СПИРТІВ
в) третинні, у яких ОН-група пов'язана з третинним атомом вуглецю. Третинний вуглецевий атом (виділено зеленим кольором) пов'язаний одночасно з трьома сусідніми атомами вуглецю, наприклад, третинний бутанол і пентанол (рис. 2).

Мал. 2. БУДОВА з третинного спирту
Відповідно до типу вуглецевого атома приєднаної до нього спиртову групу також називають первинної, вторинної або третинної.
У багатоатомних спиртів, що містять дві або більше ОН-груп, можуть бути присутніми одночасно як первинні, так і вторинні НО-групи, наприклад, в гліцерині або ксиліт (рис. 3).
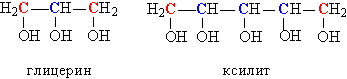
Мал. 3. ПОЄДНАННЯ В СТРУКТУРІ БАГАТОАТОМНИХ СПИРТІВ ПЕРВИННИХ І ВТОРИННИХ ОН-ГРУП.
3. За будовою органічних груп, пов'язаних ОН-групою, спирти поділяють на граничні (метанол, етанол, пропанол), ненасичені, наприклад, аліловий спирт СН2 = СН-СН 2-ОН, ароматичні (наприклад, бензиловий спирт С6Н5СН2ОН), що містять у складі групи
R ароматичну групу.
Ненасичені спирти, у яких ОН-група «примикає» до подвійного зв'язку, тобто пов'язана з атомом вуглецю, які беруть участь одночасно в освіті подвійного зв'язку (наприклад, вініловий спирт СН2 = СН-ОН), вкрай нестабільні і відразу ж ізомеризуються (див .ІЗОМЕРІЗАЦІЯ) в альдегіди або кетони:
CH2 = CH-OH ® CH3-CH = O Номенклатура спиртів. Для поширених спиртів, що мають просту будову, використовують спрощену номенклатуру: назва органічної групи перетворять в прикметник (за допомогою суфікса і закінчення «овий») і додають слово «спирт»: СН3ОН метиловий спирт С2Н5ОН етиловий спирт (Н3С) 2СНОН з пропіловий спирт С4Н9ОН бутиловий спирт В тому випадку, коли будова органічної групи більш складне, використовують загальні для всієї органічної хімії правила. Назви, складені за такими правилами, називають систематичними. Відповідно до цих правил, вуглеводневий ланцюг нумерують з того кінця, до якого ближче розміщена ОН-група. Далі використовують цю нумерацію, щоб вказати положення різних заступників уздовж основної ланцюга, в кінці назви додають суфікс «ол» і цифру, що вказує положення ОН-групи (рис. 4): 
Мал.
4. СИСТЕМАТИЧНІ НАЗВИ СПИРТІВ. Функціональні (ОН) і заміщають (СН 3) групи, а також відповідні їм цифрові індекси виділені розрізняються квітами. Систематичні назви найпростіших спиртів складають за тими ж правилами: метанол, етанол, бутанол. Для деяких спиртів збереглися тривіальні (спрощені) назви, що склалися історично: пропаргіловий спирт НС є С-СН2ОН, гліцерин HO-СH2-СН (ОН) -CH2-OH, пентаеритрит С (СН2ОН) 4, фенетіловий спирт С6Н5-CH2- CH2-OH. Фізичні властивості спиртів. Спирти розчиняються в більшості органічних розчинників, перші три найпростіших представника - метанол, етанол і пропанол, а також третинний бутанол (Н3С) 3СОН - змішуються з водою в будь-яких співвідношеннях. При збільшенні кількості атомів С в органічної групі починає позначатися гідрофобний (водовідштовхуючий) ефект, розчинність в воді стає обмеженою, а при R, що містить понад 9 атомів вуглецю, практично зникає.
Завдяки наявності ОН-груп між молекулами спиртів виникають водневі зв'язку.

Мал. 5. водневих зв'язків в спирті (показані пунктиром)
В результаті у всіх спиртів більш висока температура кипіння, ніж у відповідних вуглеводнів, наприклад, Т. кип. етанолу + 78 ° С, а Т. кип. етану -88,63 ° С; Т. кип. бутанола і бутану відповідно + 117,4 ° С і -0,5 ° С.
Хімічні властивості спиртів.Спирти відрізняються різноманітними перетвореннями.Реакції спиртів мають деякі загальні закономірності: реакційна здатність первинних одноатомних спиртів вище, ніж вторинних, в свою чергу, вторинні спирти хімічно активніші, ніж третинні.Для двоатомних спиртів, в тому випадку, коли ВІН-групи знаходяться у сусідніх атомів вуглецю, спостерігається підвищена (в порівнянні з одноатомними спиртами) реакційна здатність через взаємного впливу цих груп.Для спиртів можливі реакції, що проходять з розривом як С-О, так і О-Н - зв'язків.1. Реакції, що протікають по зв'язку О-Н.
При взаємодії з активними металами (Na, K, Mg, Al) спирти проявляють властивості слабких кислот і утворюють солі, звані алкоголятами або алкоксидами:
2
CH 3 OH + 2 Na ® 2 CH 3 OK + H 2
Алкоголяти хімічно нестабільні і при дії води гідролізуються з утворенням спирту і гідроксиду металу:
C2H5OК + H2O
® C2H5OH + КOH
Ця реакція показує, що спирти в порівнянні з водою являють собою більш слабкі кислоти (сильна кислота витісняє слабку), крім того, при взаємодії з розчинами лугів спирти не утворюють алкоголяти. Проте, в багатоатомних спиртах (в тому випадку, коли ВІН-групи приєднані до сусідніх атомів С) кислотність спиртових груп набагато вище, і вони можуть утворювати алкоголяти не тільки при взаємодії з металами, а й з лугами:
HO-CH2-CH2-OH + 2NaOH ® NaO-CH2-CH2-ONa + 2H2O Коли в багатоатомних спиртах НО-групи приєднані до НЕ сусідять атомам С, властивості спиртів близькі до одноатомних, оскільки взаємовплив НО-груп не проявляється.
При взаємодії з мінеральними або органічними кислотами спирти утворюють складні ефіри - сполуки, що містять фрагмент
R - O - A (А - залишок кислоти). Освіта складних ефірів відбувається і при взаємодії спиртів з ангідридами і хлорангидридами карбонових кислот (рис. 6).

При дії окислювачів (К2Cr2O7, KMnO4) первинні спирти утворюють альдегіди, а вторинні - кетони (рис.7)

Мал. 7. ОСВІТА АЛЬДЕГІДІВ І КЕТОНІВ ПРИ окислення спирту
Відновлення спиртів призводить до утворення вуглеводнів, що містять ту ж кількість атомів С, що молекула вихідного спирту (рис.8).
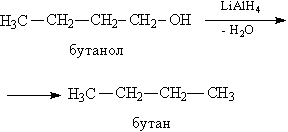
Мал.
8. ВІДНОВЛЕННЯ бутанол
2. Реакції, що протікають по зв'язку С-О.
У присутності каталізаторів або сильних мінеральних кислот відбувається дегідратація спиртів (відщеплення води), при цьому реакція може йти в двох напрямках:
а) межмолекулярная дегідратація за участю двох молекул спирту, при цьому зв'язку С-О в однієї з молекул разраваются, в результаті утворюються прості ефіри - сполуки, що містять фрагмент
R -О- R (рис. 9А).
б) при внутрімолекулярної дегідратації утворюються алкени - вуглеводні з подвійним зв'язком. Часто обидва процеси - утворення простого ефіру і алкена - протікають паралельно (рис. 9Б).
У разі вторинних спиртів при утворенні алкена можливі два напрямки реакції (рис. 9В), переважний напрямок то, при якому в процесі конденсації отщепляется водень від найменш гидрогенизированного атома вуглецю (відзначений цифрою 3), тобто оточеного меншою кількістю атомів водню (в порівнянні з атомом 1). Показання на рис. 10 реакції використовують для одержання алкенів і простих ефірів.

Розрив зв'язку С-О в спиртах відбувається також при заміщенні ОН-групи галогеном, або аминогруппой (рис. 10).
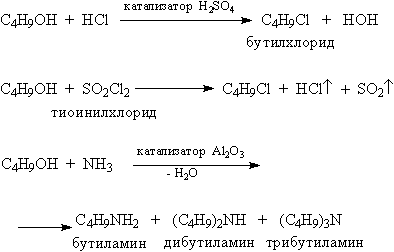
Мал. 10. ЗАМІНА ОН-ГРУПИ В спирту галогенні або аміногрупу
Реакції, показані на рис. 10, використовують для отримання галогенвуглеводні і амінів.
Отримання спиртів.Деякі з показаних вище реакцій (рис. 6,9,10) оборотні і при зміні умов можуть протікати в протилежному напрямку, приводячи до отримання спиртів, наприклад при гідролізі складних ефірів і галогенвуглеводні (рис.11 і Б, відповідно), а також гідратацією алкенов - приєднанням води (ріс.11В).
Мал. 11. ОТРИМАННЯ СПИРТІВ гідролізу і гідратації органічних сполук
Реакція гідролізу алкенов (рис. 11, схема В) лежить в основі промислового виробництва нижчих спиртів, що містять до 4 атомів С.
Етанол утворюється і при так званому спиртному бродінні цукрів, наприклад, глюкози С6Н12О6. Процес протікає в присутності дріжджових грибків і призводить до утворення етанолу і СО2:
С6Н12О6
® 2С2Н5ОН + 2СО2
Бродінням можна отримати не більше ніж 15% -ний водний розчин спирту, оскільки при більш високій концентрації спирту дріжджові грибки гинуть. Розчини спирту більш високої концентрації одержують перегонкою.
Метанол отримують в промисловості відновленням монооксиду вуглецю при 400
° С під тиском 20-30 МПа в присутності каталізатора, що складається з оксидів міді, хрому, і алюмінію:
СО + 2 Н2
® Н3СОН Якщо замість гідролізу алкенов (рис. 11) проводити окислення, то утворюються двоатомні спирти (рис. 12) 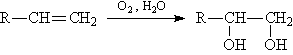
Мал.
12. ОТРИМАННЯ двоатомних спирт Застосування спиртів. Здатність спиртів брати участь в різноманітних хімічних реакціях дозволяє їх використовувати для отримання всіляких органічних сполук: альдегідів, кетонів, карбонових кислот простих і складних ефірів, що застосовуються в якості органічних розчинників, при виробництві полімерів, барвників і лікарських препаратів.
Метанол СН3ОН використовують як розчинник, а також у виробництві формальдегіду, що застосовується для отримання фенолформальдегідних смол, останнім часом метанол розглядають як перспективне моторне паливо. Великі обсяги метанолу використовують при видобутку і транспорті природного газу. Метанол - найбільш токсична сполука серед усіх спиртів, смертельна доза при прийомі всередину - 100 мл.
Етанол С2Н5ОН - вихідна сполука для отримання ацетальдегіду, оцтової кислоти, а також для виробництва складних ефірів карбонових кислот, які використовуються в якості розчинників. Крім того, етанол - основний компонент всіх спиртних напоїв, його широко застосовують і в медицині як дезінфікуючий засіб.
Бутанол використовують як розчинник жирів і смол, крім того, він служить сировиною для отримання запашних речовин (бутилацетата, бутілсаліцілата і ін.). У шампунях він використовується як компонент, що підвищує прозорість розчинів.
Бензиловий спирт С6Н5-CH2-OH у вільному стані (і у вигляді складних ефірів) міститься в ефірних маслах жасмину і гіацинта. Він має антисептичні (знезаражувальні) властивостями, в косметиці він використовується як консервант кремів, лосьйонів, зубних еліксирів, а в парфумерії - як запашне речовина.
Фенетіловий спирт С6Н5-CH2-CH2-OH володіє запахом троянди, міститься в рожевому маслі, його використовують в парфумерії.
Етиленгліколь HOCH2-CH2OH використовують у виробництві пластмас і як антифриз (добавка, яка б знизила температуру замерзання водних розчинів), крім того, при виготовленні текстильних і друкарських фарб.
Діетиленгліколь HOCH2-CH2OCH2-CH2OH використовують для заповнення гальмівних гідравлічних пристосувань, а також в текстильній промисловості при обробці і фарбуванні тканин.
гліцерин
HOCH 2 CH (OH) - CH 2 OH застосовують для отримання поліефірних гліфтальових смол, крім того, він є компонентом багатьох косметичних препаратів. Нітрогліцерин (рис. 6) - основний компонент динаміту, що застосовується в гірничій справі і залізничному будівництві як вибухова речовина.
Пентаеритрит (
HOCH 2) 4С застосовують для отримання поліефірів (пентафталеві смоли), в якості затверджувача синтетичних смол, як пластифікатор полівінілхлориду, а також у виробництві вибухової речовини тетранітропентаерітріта.
Поліспирти ксиліт НОСН2- (СНОH) 3-CН2ОН і сорбіт neНОСН2- (СНОН) 4-СН2OН мають солодкий смак, їх використовують замість цукру у виробництві кондитерських виробів для хворих на діабет і людей страждають від ожиріння. Сорбіт міститься в ягодах горобини і вишні.
Михайло Левицький
ЛІТЕРАТУРАШабаров Ю.С.Органічна хімія.Москва, «Хімія», 1994